據外媒BGR報道,美國食品和藥物管理局(FDA)局長史蒂芬·哈恩(Stephen Hahn)在Twitter上表示,外部專家將對已經達到3期試驗的新冠疫苗進行審查。此前,COVID-19疫苗競賽最近有了新的進展,FDA也對COVID-19的血漿療法進行了有爭議的緊急使用授權。
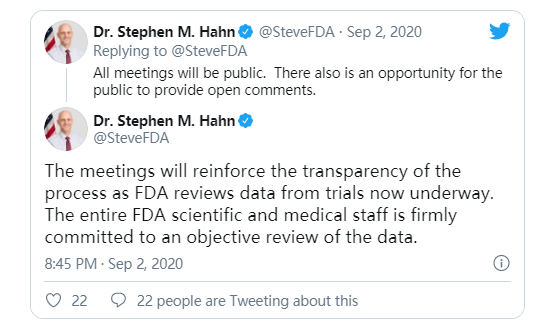
大型制藥公司的投資、美國等政府的資助以及比爾和梅琳達·蓋茨基金會等其他來源的資金,都幫助快速推進美國的COVID-19疫苗工作。但研究人員和衛生官員一再表示,在最後的3期試驗完成之前,疫苗不會被推廣。周三FDA進一步重申了擁有科學證明候選疫苗有效的重要性,確認一個獨立專家小組將分析3期試驗的數據。
迄今為止,已有170多種候選疫苗注冊,其中至少有6種已經進入最後的測試階段,3種在中國,3種在美國和歐洲。來自俄羅斯的第7種候選藥物也處於第三階段,並已獲得緊急使用授權。參與所有項目的科學家(除了俄羅斯的藥物)都已經發表了論文,詳細介紹了迄今為止的1期和2期試驗情況。俄羅斯在沒有向世界證明疫苗有效的情況下,就繼續批准其藥物的緊急使用,引起了很多批評。
而FDA此前確實為COVID-19恢復期血漿治療頒發了緊急使用授權(EUA)。到目前為止,血漿療法已經挽救了生命,減少了新冠重症患者的並發症。一些研究證明,如果在入院後早期給予血漿治療,並且含有大量的中和抗體,那麼血漿治療是有用的。但這些研究都沒有達到監管機構在批准藥物時需要的標準要求。FDA甚至在沒有獲得隨機、安慰劑對照、雙盲血漿研究的情況下就批准了這種藥物,而這種研究可以提供更客觀的結果。
FDA局長哈恩最近在白宮的一次發布會上因為他認可治療的方式而受到批評,在隨後的幾天里,他在Twitter上承認了自己的錯誤。但話題已經轉移到了疫苗上,因為有報道稱,美國總統特朗普可能會向官員施壓,要求他們在11月初總統大選前批准一種COVID-19疫苗緊急使用。
哈恩最近表示,疫苗製造商可能會在3期試驗結束前要求獲得EUA,FDA將不得不做出決定。但他明確表示,政治不會在FDA的決定中發揮作用。
另外,安東尼·福奇博士曾解釋說,在數據能夠證明疫苗安全有效之前,發放緊急批准將危及整個研究工作。福奇在隨後的發言中表示,可能會在11月得到關於疫苗療效的答案,然後他認為疫苗可能會在今年年底前准備就緒。即使在這種情況下,成功的疫苗也不會立即用於大規模的疫苗接種活動。包括老年人和醫護人員在內的高危人群,可能會在緊急免疫接種計劃中最先獲得疫苗。福奇指出,美國民眾能夠盡早獲得疫苗的唯一方法是,如果藥物在階段性試驗中表現出色,那麼就可以獲得疫苗。
來源:cnBeta